C’est la première fois que sont mis en évidence de tels liens familiaux chez des Néandertaliens, une espèce du genre Homo disparue il y a environ 49 000 ans. Pour ce faire, les chercheurs apparenant à différentes nations (comme pour le projet iter sur le nucléaire civil) ont analysé l’ADN de onze individus prélevé dans des fragments d’os et de dents qui avaient été déterrés dans la grotte de Tchagyrka, en Sibérie. Que cette découverte ait lieu dans l’altaï russe témoigne une fois de plus de l’unité du destin de l’espèce et de notre planète commune et dans notre continent. Ces onze personnes auraient vécu à la même époque. Il s’avère que les éditions Delga m’ont confié la préface du manuel scolaire de l’Union soviétique sur les origines de l’espèce humaine et l’histoire antique, en le lisant j’ai retrouvé les joies éprouvées il y a bien longtemps, dans mes propres études, à cette conception de l’histoire qui unit le matérialisme historique de Marx et Engels à toutes les découvertes sur l’évolution de l’humanité, les méthodes qui ne se contentent plus des chroniques et des textes mais utilisent les découvertes anthropologiques et archéologiques, les datations des objets en laboratoire. En relisant ce manuel pour en rédiger la préface, je songeais à l’apport aujourd’hui de la génétique des populations et aux travaux qui ont porté sur les peuplements humains, les hybridations . Aujourd’hui, je découvre cette découverte de l’organisation sociale de Néanderthal -dont nous avons les gênes- me fait percevoir la continuité et les avancées depuis L’Origine de la famille, de la propriété privée et de l’État un essai de Friedrich Engels publié en 1884 d’après les notes de Karl Marx sur les études anthropologiques des sociétés archaïques de Lewis Henry Morgan. livre auquel le manuel fait souvent référence. Engels se réfère aussi au livre Le Droit maternel de Johann Jakob Bachofen. OUI la révolution d’octobre a bien initié une autre civilisation, une autre conception de l’humain et celle-ci comme la taupe de l’histoire poursuit sur sa lancée, le passé y est promesse d’avenir. (note de danielle bleitrach pour histoireetsociete)
“Grâce à l’analyse de fossiles trouvés dans une grotte en Russie, des scientifiques ont découvert la première famille connue de Néandertaliens : un père, une adolescente et d’autres individus qui étaient probablement des cousins proches”, rapporte le New York Times. Le quotidien américain se fait l’écho de l’étude parue le 19 octobre dans Nature, codirigée par Svante Pääbo, lauréat du prix Nobel 2022 de médecine.Il crée en 1997 un centre de recherche en paléogénétique au sein de l’Institut Max Planck d’anthropologie évolutionniste. En mars 2010, son équipe annonce l’identification d’une nouvelle espèce d’hominidé à partir de matériel génétique, l’hominidé de Denisova. Il s’agit de la première identification d’une espèce humaine par le seul décodage d’ADN fossile. Son équipe publie aussi en 2010 la séquence ADN presque complète de Néandertal. Il montre aussi que 1 à 3 % d’ADN de Néandertal est encore présent aujourd’hui dans le génome d’une large part de l’humanité. Il est Docteur Honoris Causa de l’université de Galway en 2015. Il reçoit le Prix scientifique européen Körber en 2018.
Aperçu génétique de l’organisation sociale des Néandertaliens
- Laurits Skov,
- Stéphane Peyrégne,
- Divyaratan Popli,
- Leonardo N. M. Iasi,
- Thibaut Devièse,
- Viviane Slon,
- Elena I. Zavala,
- Mateja Hajdinjak,
- Arev P. Sümer,
- Grotte Steffi,
- Alba Bossoms Mesa,
- David López Herráez,
- Birgit Nickel,
- Sarah Nagel,
- Julia Richter,
- Elena Essel,
- Marie Gansauge,
- Anna Schmidt,
- Petra Korlević,
- Daniel Comeskey,
- Anatoly P. Derevianko,
- Aliona Kharevich,
- Sergueï V. Markin,
- Sahra Talamo,
- …
- Benjamin M. Peter
Afficher les auteurs
Nature volume 610, pages519–525 (2022)Citer cet article
- 58kAccès
- 3341 Altmetric
- Métriquedetails
Abstrait
Les analyses génomiques des Néandertaliens ont déjà fourni des informations sur l’histoire de leur population et leur relation avec les humains modernes.1,2,3,4,5,6,7,8, mais l’organisation sociale des communautés néandertaliennes reste mal comprise. Nous présentons ici les données génétiques de 13 Néandertaliens de deux sites du Paléolithique moyen dans les montagnes de l’Altaï au sud de la Sibérie: 11 de la grotte de Chagyrskaya9,10et 2 de la grotte d’Okladnikov11—ce qui en fait l’une des plus grandes études génétiques d’une population néandertalienne à ce jour. Nous avons utilisé la capture d’hybridation pour obtenir des données nucléaires à l’échelle du génome, ainsi que des séquences mitochondriales et du chromosome Y. Certains individus Chagyrskaya étaient étroitement liés, y compris une paire père-fille et une paire de parents au deuxième degré, ce qui indique qu’au moins certains des individus vivaient en même temps. Jusqu’à un tiers des génomes de ces individus avaient de longs segments d’homozygotie, ce qui suggère que les Néandertaliens Chagyrskaya faisaient partie d’une petite communauté. En outre, la diversité du chromosome Y est d’un ordre de grandeur inférieure à la diversité mitochondriale, un modèle que nous avons trouvé mieux expliqué par la migration féminine entre les communautés. Ainsi, les données génétiques présentées ici fournissent une documentation détaillée de l’organisation sociale d’une communauté néandertalienne isolée à l’extrême est de son aire de répartition connue.
Principal
Les Néandertaliens occupaient l’Eurasie occidentale il y a environ 430 000 ans8,12jusqu’à leur extinction il y a environ 40 000 ans13. Des données à l’échelle du génome ont été rapportées pour les restes squelettiques de 18 individus provenant de 14 sites archéologiques1,2,3,4,5,6,7,8couvrant l’histoire de Néandertal sur de grandes parties de leur aire de répartition géographique connue, qui s’étend aussi loin à l’est que les montagnes de l’Altaï dans le sud de la Sibérie. Ces données ont permis d’obtenir une vue d’ensemble des populations néandertaliennes, indiquant l’existence de multiples populations néandertaliennes distinctes au fil du temps et de l’espace.1,2,14.
Cependant, on sait peu de choses sur les relations génétiques et l’organisation sociale au sein et entre les communautés néandertaliennes dans n’importe quelle partie de l’Eurasie pendant cet intervalle de temps.
Par « organisation sociale », nous entendons la taille, la composition sexuelle et la cohésion spatio-temporelle d’une communauté15. Nous définissons une communauté comme un ensemble d’individus qui vivaient vraisemblablement ensemble au même endroit, et réservons le terme population à un ensemble de communautés largement connectées dans une zone géographique plus large.
Sur la base d’empreintes fossilisées16,17et les modèles spatiaux d’utilisation du site18, des études antérieures sur l’organisation sociale des communautés néandertaliennes ont suggéré que les Néandertaliens vivaient probablement dans de petites communautés. En outre, des séquences partielles d’ADN mitochondrial (ADNmt) de six Néandertaliens adultes ont été utilisées pour suggérer que les Néandertaliens pourraient avoir été patrilocaux19, bien que cette suggestion ait fait l’objet d’un débat20.
Nous explorons ici l’organisation sociale des Néandertaliens à l’aide de données nucléaires, chromosomiques Y et ADNmt provenant des restes de 13 individus récupérés sur 2 sites situés à proximité l’un de l’autre dans le sud de la Sibérie (Russie) – les grottes de Chagyrskaya et d’Okladnikov (Tableau1et Fig.1a).
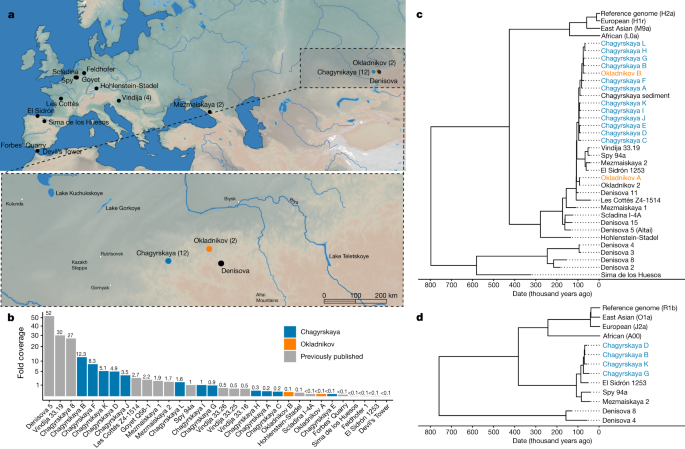
Tableau 1 Néandertaliens des grottes de Chagyrskaya et d’Okladnikov inclus dans cette étudeTable pleine grandeur
Sites archéologiques et vestiges
Les grottes de Chagyrskaya et d’Okladnikov, situées dans les contreforts des montagnes de l’Altaï (Fig.1aet Extended Data Figs.1 et2), auraient été utilisées principalement comme camps de chasse à court terme11,21. Ce sont deux des trois sites connus sur lesquels une industrie distincte du Paléolithique moyen de Sibiryachikha a été trouvée (le troisième étant la grotte supérieure de Sibiryachikha).9,10,22,23(Fig.1.6 supplémentaire). L’industrie de Sibiryachikha dans les grottes de Chagyrskaya et d’Okladnikov est distincte de l’industrie du Paléolithique moyen de la grotte de Denisova (située à environ 100 km à l’est), où des restes néandertaliens ont également été trouvés.2.
Les dépôts d’occupation néandertalienne de la grotte de Chagyrskaya se sont accumulés il y a entre 59 000 et 51 000 ans, comme l’indiquent la datation optique des sédiments et la datation au radiocarbone des os de bisons10. Nous avons obtenu des âges radiocarbone supplémentaires à partir de deux morceaux de charbon de bois et d’un os de Néandertal (Chagyrskaya 9), qui étaient tous plus vieux de 50 000 ans avant le présent (tableau supplémentaire1.3). Ces âges sont compatibles avec une courte période de dépôt (quelques millénaires ou moins), ce qui est cohérent avec la présence d’une industrie archéologique similaire dans toutes les couches néandertaliennes10(Données étendues Fig.2).
Pour la grotte d’Okladnikov, nous avons limité le moment de l’occupation néandertalienne en utilisant des âges radiocarbone à acide aminé unique à base d’hydroxyproline pour trois spécimens de Néandertal (y compris Okladnikov 15) (tableau 1 et tableau de données étendu 1), ce qui indiquait qu’ils avaient au moins 44 000 ans (tableau supplémentaire1.4). Nos estimations d’âge sont cohérentes avec les âges de la série d’uranium pour les os d’animaux et soutiennent les suggestions précédentes selon lesquelles les âges radiocarbone plus jeunes obtenus à partir de la fraction de collagène reflètent une élimination incomplète des contaminants24(Renseignements supplémentaires, section1). Par conséquent, les données archéologiques et chronologiques suggèrent que les Néandertaliens qui occupaient ces deux sites pourraient avoir été largement contemporains.
Des analyses antérieures des génomes à haute couverture d’un Néandertalien de la grotte de Chagyrskaya (Chagyrskaya 8) et d’un Néandertalien antérieur de la grotte de Denisova (Denisova 5, le « Néandertalien de l’Altaï ») ont révélé qu’ils appartenaient à des populations différentes5. Une progéniture de première génération (Denisova 11) d’une mère néandertalienne et d’un père dénisovien a révélé que la mère néandertalienne ressemblait plus à Chagyrskaya 8 qu’elle ne l’était aux autres Néandertaliens.5,25.
Acquisition des données et détermination du sexe
Nous avons échantillonné 1 à 64 mg de poudre dentaire ou osseuse provenant de 17 spécimens de la grotte de Chagyrskaya et de 10 spécimens de la grotte d’Okladnikov. Parmi ceux-ci, 15 de Chagyrskaya et 2 d’Okladnikov ont produit de l’ADN ancien (tableau 1, tableau dedonnées étendu 1 et données supplémentaires1), à partir desquels nous avons généré un total de 85 banques d’ADN simple brin (section2 des informations supplémentaires). Toutes les banques ont été enrichies pour les séquences d’ADNmt (section3 des renseignements supplémentaires) et 49 bibliothèques (sélectionnées pour les rendements élevés des séquences et les faibles niveaux de contamination humaine actuelle) ont été enrichies pour l’ADN nucléaire à l’aide d’un réseau de capture nucléaire nouvellement conçu contenant 643 472 polymorphismes de transversion à travers le génome (section5 des renseignements supplémentaires) ). Dans le tableau, 271 306 sites varient parmi les 4 individus archaïques à couverture élevée publiés (trois Néandertaliens et un Denisovan)2,3,5,14et 372 166 sites se séparent dans les populations africaines actuelles ou sont fixés entre les humains actuels et les hominidés archaïques. La couverture moyenne de l’ADN nucléaire pour chaque fossile varie de 0,04 à 12,3 fois (Fig.1b), et les estimations actuelles de la contamination humaine vont de 0,1 % à 3,2 % (tableau supplémentaire5.4).
Nous avons déterminé le sexe génétique des 17 restes en utilisant la différence de couverture entre le chromosome X et les autosomes (Fig.5.5 supplémentaire) et avons constaté que 6 restes provenaient de femelles. Pour les 11 restes mâles, nous avons enrichi les bibliothèques pour environ 6,9 mégabases (Mb) de séquence du chromosome Y.26(Renseignements supplémentaires, section 4), ce qui donne des couvertures allant de 0,02 à 42,2 fois (tableau supplémentaire4.3).
Identification des proches
Pour déterminer si l’un des restes provenait d’individus apparentés, nous avons calculé la divergence de l’ADN nucléaire entre les 17 restes en échantillonnant au hasard 1 allèle de 250 785 sites dans le réseau de capture qui étaient variables chez les individus archaïques à couverture élevée (à l’exclusion des variantes spécifiques à Chagyrskaya 8) (Informations supplémentaires section5 ). La divergence sera plus faible pour les individus apparentés parce qu’ils ont hérité de parties de leur génome des ancêtres qu’ils partagent dans un passé récent. Nous avons normalisé cette divergence (p0) par une divergence médiane de l’ADN entre toutes les comparaisons. Utilisation de cette approche27, nous pouvons détecter des relations jusqu’au deuxième degré; Nous considérons que tout ce qui va au-delà de cela n’a aucun rapport. Nous attendonsp0= 1 pour les restes qui sont plus éloignés que les parents au deuxième degré,p0= 0,875 pour les parents au deuxième degré,p0= 0,75 pour les parents au premier degré etp0= 0,5 pour les restes de jumeaux monozygotes ou du même individu27. Nous avons également étudié les hétéroplasmies d’ADNmt (c’est-à-dire lorsque les mitochondries portées par un individu diffèrent dans leur séquence d’ADN) (tableau supplémentaire3.2) pour identifier les relations génétiques étroites28. Comme les hétéroplasmies peuvent être transmises de la mère à l’enfant et persistent généralement pendant moins de trois générations29, leur présence dans des restes différents indiquerait qu’ils proviennent du même individu ou d’individus proches de la mère. Pour différencier les restes (c’est-à-dire entre les échantillons squelettiques et dentaires) et les individus, nous désignons les premiers par des chiffres et les seconds par des lettres (tableau1).
Nous avons trouvé une dent caduque (Chagyrskaya 19) et deux dents permanentes (Chagyrskaya 13 et Chagyrskaya 63). Étonnamment, malgré leurs différents stades de développement, les données génétiques suggèrent qu’ils appartenaient au même individu (Chagyrskaya G;p moyen0= 0,53) (données étendues fig.3a). En accord avec cela, les trois dents provenaient d’un mâle et portaient des ADNmt identiques, y compris une hétéroplasmie en position 3 961 à des fréquences similaires de 60,7 à 78,5% (tableau supplémentaire3.2). La racine presque complètement résorbée de la dent à feuilles caduques suggère qu’elle a été exfoliée naturellement (renseignements supplémentaires, section1). Sur la base des modèles d’usure et de développement racinaire, nous avons déduit que les dents permanentes provenaient d’un individu âgé de 9 à 15 ans et que cet homme est probablement mort à peu près au moment où la dent à feuilles caduques a été perdue.
Nous avons également identifié deux autres ensembles d’individus avec plusieurs fossiles: Chagyrskaya C est représenté à la fois par Chagyrskaya 6, une mandibule, et Chagyrskaya 14, une incisive permanente (section1 des informations supplémentaires), comme en témoignent l’ajustement morphologique, les séquences d’ADNmt identiques (y compris une hétéroplasie partagée) et la faible divergence nucléaire (p0= 0,65; intervalle de confiance à 95 %, 0,34–0,78) (Fig.1c, données étendues Fig.3aet tableaux supplémentaires3.2 et 7.1). De même, Chagyrskaya F est représenté à la fois par Chagyrskaya 12 et par le séquençage précédent5 Chagyrskaya 8 (p0= 0,46; intervalle de confiance à 95 %, 0,41 à 0,46) (tableau supplémentaire7.1).
Un homme adulte, Chagyrskaya D, était étroitement lié à plusieurs autres individus du groupe. Nous avons trouvé une relation au premier degré entre lui et Chagyrskaya H, qui est une adolescente (p0= 0,77; Intervalle de confiance à 95 %, 0,72–0,82). Il existe trois combinaisons hommes-femmes possibles pour les parents au premier degré : mère-fils, frère-sœur ou père-fille. Cependant, puisque les deux individus portent des génomes mitochondriaux différents (Fig.1c), nous avons conclu que Chagyrskaya H était la fille de Chagyrskaya D.
De plus, son ADNmt était identique à celui de deux autres mâles, Chagyrskaya C et Chagyrskaya E (tableau supplémentaire3.2), y compris une hétéroplasmie d’ADNmt partagée en position 545 (G>A) avec une fréquence de A de 42 à 54 % pour Chagyrskaya D, de 20 à 41 % pour Chagyrskaya E et de 23 à 30 % pour Chagyrskaya C. Par conséquent, ces personnes étaient probablement des parents maternels proches (par exemple, ils auraient pu partager une grand-mère et donc avoir été des parents au quatrième degré). Cependant, l’étendue de la relation entre Chagyrskaya C et Chagyrskaya D dépasse la résolution de notre approche (p0= 1,05; Intervalle de confiance à 95 %, 0,94–1,16). Chagyrskaya E a une faible couverture (tableau supplémentaire 5.4) et des quantités élevées de contamination humaine et non humaine (tableau supplémentaire5.3). Après correction de la contamination non humaine (tableau supplémentaire7.1), nous avons identifié Chagyrskaya E comme un parent au premier degré ou identique à Chagyrskaya D (p0= 0,64; Intervalle de confiance à 95 %, 0,48 à 0,79). Comme nous ne pouvons pas être sûrs que Chagyrskaya E est un individu distinct, nous avons retiré l’échantillon d’une analyse plus approfondie.
Les relations étroites entre Chagyrskaya C, D et H impliquent qu’ils étaient contemporains. De plus, nous avons constaté que Chagyrskaya A (homme) et L (femme) sont des parents au deuxième degré (p0= 0,85; Intervalle de confiance à 95 %, 0,77 à 0,91). Bien que les données éparses nous aient empêchés de déterminer la relation exacte, elles doivent également avoir vécu près dans le temps (données étendues Fig.3b). La divergence génétique entre chaque groupe d’individus contemporains et les six autres individus Chagyrskaya n’était pas significativement différente les unes des autres (test de somme de rang de Wilcoxon, tous deuxP> 0,26) (tableau supplémentaire7.4). En outre, la paire père-fille contemporaine présentait le plus grand nombre de différences parmi toutes les séquences d’ADNmt, ce qui implique qu’il n’y avait pas de structure temporelle substantielle dans la diversité de l’ADNmt. Prises ensemble, les données ont soutenu l’hypothèse selon laquelle les onze Néandertaliens Chagyrskaya faisaient partie de la même communauté.
Les deux restes d’Okladnikov n’étaient pas liés l’un à l’autre (p0= 1,14; intervalle de confiance à 95%, 0,90-1,38) et non plus lié à un individu de la grotte de Chagyrskaya. En fait, la divergence génétique par paires entre les individus Chagyrskaya était plus faible (p0= 1,0; Intervalle de confiance de 95 %, 0,99–1,02) que celui entre les individus des grottes de Chagyrskaya et d’Okladnikov (p0= 1,06; Test de somme de rang de Wilcoxon, P = 8,6 × 10−5) (données étendues fig. 3aet tableau supplémentaire7.3). Cela indique que les Néandertaliens de l’Okladnikov ne faisaient pas partie de la communauté néandertalienne Chagyrskaya représentée par les 11 individus pour lesquels nous avons obtenu de l’ADN. Cependant, l’ADNmt d’Okladnikov B est identique à celui de Chagyrskaya G (Fig.1c). Étant donné que les mutations s’accumulent au fil du temps, l’ADN mt identique entre les individus implique que ces deux individus ont vécu à quelques milliers d’années l’un de l’autre (tableau supplémentaire3.9). En outre, parmi les échantillons d’ADNmt de sédiments précédemment publiés dans la grotte de Chagyrskaya, 2 des 38 échantillons ressemblaient davantage à Okladnikov A qu’à n’importe quel Néandertalien de Chagyrskaya.30. Cela suggère qu’il y avait un certain lien entre les communautés occupant les deux grottes.
Relations avec d’autres populations
Pour explorer comment les individus de Chagyrskaya et d’Okladnikov sont liés aux autres Néandertaliens, nous avons étudié dans quelle mesure ils partagent des variantes nucléotidiques avec les génomes néandertaliens de haute qualité précédemment publiés. Les 13 individus nouvellement séquencés partageaient la plupart des variantes avec le génome à haute couverture de la grotte de Chagyrskaya (Chagyrskaya 8)5et ressemblaient davantage au génome néandertalien vieux d’environ 50 000 ans de la grotte de Vindija (Vindija 33.19)3en Croatie qu’à l’Altaï Néandertal (Denisova 5), vieux de 91 000 à 130 000 ans, de la grotte de Denisova2(données étendues fig.4). Par conséquent, bien que les communautés des grottes de Chagyrskaya et d’Okladnikov soient génétiquement distinctes, elles semblent toutes également apparentées aux Néandertaliens européens et faisaient partie de la même population néandertalienne; aucun individu n’a montré de preuve de flux génétique récent provenant d’autres populations néandertaliennes.
Nous avons identifié 5 416 variantes dans la séquence de 6,9 Mb du chromosome Y qui variaient entre les chromosomes Y des sept individus masculins, trois Néandertaliens, deux Denisovans et quatre humains actuels (tableau supplémentaire4.7). Pour trois individus, nous n’avons obtenu que des séquences de faible couverture (0,03 à 0,3 fois), tandis que les quatre autres individus ont donné des couvertures plus élevées (1,75 à 42,2 fois) (tableau supplémentaire4.3).
Nous avons construit un arbre phylogénétique qui incorporait les quatre séquences du chromosome Y à couverture plus élevée de la grotte Chagyrskaya, ainsi que celles de trois autres Néandertaliens, deux Denisovans et quatre humains actuels (Fig.1det Tableau supplémentaire4.7). Chez les Néandertaliens, les quatre séquences de Chagyrskaya forment un clade, mais elles ressemblent davantage à El Sidrón 1253 (Espagne) qu’à Mezmaiskaya 2, géographiquement plus proche (Caucase du Nord, Russie) (Fig.1d). Cette absence de structure géographique est compatible avec une expansion assez rapide des Néandertaliens il y a environ 100 000 à 115 000 ans.30. Les Néandertaliens européens tardifs et les Néandertaliens Chagyrskaya et Okladnikov sont les descendants de cette population.
Le nombre de séquences du chromosome Y récupérées chez les trois individus restants n’était pas suffisant pour construire un arbre phylogénétique, mais à des positions où les chromosomes Y de Néandertal différaient les uns des autres, les trois séquences partageaient plus de variantes dérivées avec les autres chromosomes Y de Chagyrskaya qu’avec d’autres chromosomes Y de Néandertal (tableau supplémentaire4.9).
Sur la base des différences de couverture dans les fenêtres de 10 kilobases (kb), nous avons détecté 3 délétions et 5 duplications (20-2 000 kb et 10-200 kb en taille, respectivement) (tableau supplémentaire4.4) sur les chromosomes Y de Néandertal. La délétion la plus importante a été trouvée dans Mezmaiskaya 2 et couvre le gène codant pour AMELY. Parce que les approches protéomiques utilisent la présence de peptides AMELY pour déterminer si un os provient d’un individu masculin31, les hommes qui portent cette suppression seraient classés à tort comme des femmes en utilisant cette approche (données étendues Fig.5).
L’ADNmt et les chromosomes Y ne suivent que des loci uniques, de sorte que des analyses génétiques autosomiques sont nécessaires pour étudier les détails du flux génétique. Le flux génétique entre les Néandertaliens et les Denisovans dans les montagnes de l’Altaï a été observé dans le génome nucléaire d’un individu (Denisova 11) qui vivait il y a 79 000 à 118 000 ans et avait une mère néandertalienne et un père dénisovien.32. Il a également été estimé que la quantité d’ascendance Denisovan dans Chagyrskaya 8 est d’environ 0,09% et que l’événement de mélange s’est produit 24 300 ± 14 100 ans avant que Chagyrskaya 8 ne vive33. Pour déterminer si le moment du mélange est cohérent chez les autres individus Chagyrskaya, nous avons recherché des parties de leurs génomes qui ressemblent davantage au génome de Denisova qu’aux Néandertaliens de l’Altaï ou de Vindija.33. Avec cette analyse, nous avons identifié 11 segments d’ascendance dénisovienne chez 5 individus Chagyrskaya qui mesurent plus de 0,2 centimorgans (cM) (tableau supplémentaire6.2). Ces segments couvrent 3,2 cM (2,7 Mb), le plus long à 1,5 cM (746 kb) se trouvant dans Chagyrskaya A (Fig.6.2 supplémentaire). Sur la base de la longueur de ces segments, nous estimons que l’événement de mélange s’est produit 30 000 ± 18 000 ans avant la vie des individus Chagyrskaya, ce qui est cohérent avec l’estimation précédente (Fig.6.3 supplémentaire).
La grotte de Denisova était occupée à la fois par les Néandertaliens et les Denisovans à peu près au même moment où les Néandertaliens habitaient la grotte de Chagyrskaya34,35. Cependant, l’industrie des artefacts en pierre de la grotte de Denisova n’a pas les caractéristiques de la variante Sibiryachikha trouvée dans la grotte de Chagyrskaya10. En conséquence, malgré la proximité des deux grottes et la présence d’une progéniture d’une mère néandertalienne et d’un père dénisovien dans la grotte de Denisova quelques dizaines de millénaires avant l’occupation de la grotte de Chagyrskaya25, nous ne trouvons aucune preuve de flux génétique des Dénisoviens vers les Néandertaliens Chagyrskaya au cours des 20 000 dernières années avant la vie des individus Chagyrskaya (section6 des informations supplémentaires).
Inférer l’organisation sociale
Nous avons étudié la communauté et la taille de la population des Néandertaliens Chagyrskaya au fil du temps en utilisant des segments génomiques d’homozygotie de 8 individus (ceux ayant une couverture génomique supérieure à 0,9 fois) (section9 des informations supplémentaires). De longs segments d’homozygotie (supérieurs à 10 cM) chez un individu impliquent que leurs parents partageaient un ancêtre commun très récent il y a une dizaine de générations et faisaient donc probablement partie d’une petite communauté.5,36. En outre, la proportion globale du génome avec des segments de longueur intermédiaire d’homozygotie (2,5–10 cM) est informative de la taille de la population sur une période légèrement plus longue (environ 10–40 générations).
Des analyses antérieures de génomes néandertaliens à couverture élevée des montagnes de l’Altaï ont révélé qu’environ 16,7% du génome de Denisova 5 (réf.2) et 19,3 % du génome de Chagyrskaya 8 (réf.5) présentaient des segments intermédiaires et longs d’homozygotie. Une explication de ces tendances est que leurs parents étaient des parents au deuxième degré.2dans un contexte d’individus non apparentés, auquel cas nous nous attendrions à ce que la plupart des autres individus aient moins de segments homozygotes. Alternativement, ces données pourraient être dues à de petites communautés locales5, auquel cas tous les individus, à l’exception des immigrants récents et de leurs descendants, auraient des segments étendus d’homozygotie.
Chez les 8 individus ayant une couverture suffisante, nous avons observé que 1,6 à 14,9% du génome avait de longs segments d’homozygotie et 9,5 à 20,5% avaient des segments intermédiaires d’homozygotie (Fig.2aet tableau supplémentaire9.2). Nous notons que les deux proportions étaient probablement sous-estimées en raison des difficultés à identifier les séries d’homozygotie à des couvertures plus faibles (tableau supplémentaire9.1). Parce que nous trouvons de grandes quantités d’homozygotie chez tous les individus, nous concluons que la taille de la communauté locale des Néandertaliens Chagyrskaya était petite. La quantité d’homozygotie est également similaire à la quantité trouvée dans les génomes des gorilles de montagne actuels.37(Fig.2b), une espèce en voie de disparition qui vit dans de petites communautés de 4 à 20 individus38, dans lequel il a été observé que les accouplements entre individus apparentés au deuxième degré sont rares39.
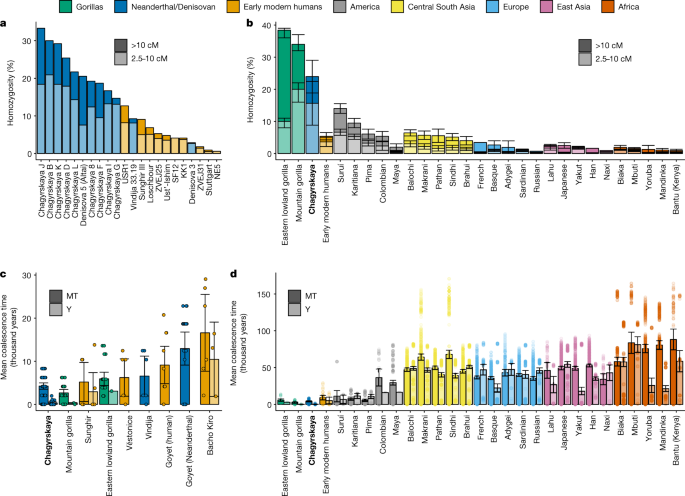
Pour approfondir l’organisation sociale des Néandertaliens Chagyrskaya, nous avons comparé la diversité des 11 séquences d’ADNmt héritées par la mère avec les 6 séquences du chromosome Y héritées par le père. Dans une population d’accouplement aléatoire sans processus fondés sur le sexe, le temps de coalescence moyen devrait être le même pour les deux marqueurs uniparentaux. Cependant, le temps de coalescence moyen observé pour le chromosome Y (446 ans ; intervalle de confiance à 95 %, 113–1 116 ans) est significativement inférieur à celui du génome mitochondrial (4 348 ans ; intervalle de confiance à 95 %, 2 043–6 196 ans ; Test de somme de rang de Wilcoxon, P = 4,1 × 10–5). En comparaison avec 47 populations humaines modernes et 10 sous-espèces de grands singes, les Néandertaliens Chagyrskaya ont parmi les ratios les plus bas du temps de coalescence du chromosome Y à l’ADNmt, seuls les gorilles de montagne ayant un rapport plus extrême (Extended Data Fig.6). Nous avertissons que des ratios similaires entre les singes et les Néandertaliens ne signifient pas nécessairement que les communautés ont la même organisation sociale, car il y a de multiples mises en garde. Premièrement, les données sur les grands singes sont très hétérogènes — par exemple, bien que certains grands singes soient nés à l’état sauvage, d’autres sont nés en captivité (c’est-à-dire dans des communautés artificielles) et souvent la taille des échantillons était très petite (tableau supplémentaire8.1). Deuxièmement, plusieurs scénarios différents peuvent conduire à des rapports chromosome-chromosome-mt-ADNmt similaires. Il s’agit notamment des différences dans les générations masculines et féminines, d’une répartition asymétrique de la progéniture chez les hommes (c’est-à-dire qu’un sous-ensemble d’hommes engendre la majorité des enfants) et d’une migration biaisée par les femmes. Pour tester l’importance relative de ces processus, nous avons simulé un grand nombre de combinaisons de ces scénarios, en tenant compte de la diversité des chromosomes Y et de l’ADNmt et de leur rapport aux données observées (section8 des informations supplémentaires). Nous avons approximé la probabilité de chaque scénario en utilisant des simulations comme proportion d’ensembles de données simulés qui se situent dans les intervalles de confiance à 95 % des données observées. Nous avons ensuite utilisé le critère d’information d’Akaike (AIC) pour classer différents scénarios (tableau supplémentaire8.5).
Les scénarios les mieux adaptés (ICE = 6,2) supposaient une collectivité de 20 personnes, 60 à 100 % des femmes étant des migrantes d’une autre collectivité (tableau supplémentaire8.4). Cependant, l’hétéroplasmie partagée entre Chagyrskaya C et Chagyrskaya D suggère qu’au moins certaines femelles sont restées dans le groupe dans lequel elles sont nées. Les scénarios qui ne comprennent que des distributions de progéniture asymétriques expliquent moins bien les données (AIC = 7,4) et nécessitent une grande taille de communauté de 300 individus. Les scénarios avec à la fois des distributions de progéniture asymétriques et des migrations femelles n’améliorent pas l’ajustement (AIC = 8,5) obtenu en supposant uniquement un biais de migration. Les scénarios qui ne comprennent que des différences dans le temps de génération correspondent mal aux données (ICE = 8,5) et nécessitent des paramètres qui semblent irréalistes (par exemple, les femmes devraient être en moyenne deux fois plus âgées que les hommes, tableau supplémentaire8.4). Les estimations précédentes de la taille des communautés néandertaliennes varient de 3 à 60 individus5,16,17,19et, dans cette fourchette, les scénarios les mieux adaptés incluent la migration des femmes (figure supplémentaire 8.4). Ce résultat suggère que la migration biaisée par les femmes a été un facteur majeur dans l’organisation sociale de la communauté néandertalienne Chagyrskaya.
Conclusion
Nous présentons les données génétiques de 13 Néandertaliens, ce qui en fait l’une des plus grandes études génétiques d’une population néandertalienne. Pour la première fois, à notre connaissance, nous documentons les relations familiales entre les Néandertaliens, y compris un couple père-fille.
Le degré élevé d’homozygotie chez tous les individus est similaire à ce que l’on observe chez les gorilles de montagne.40, ce qui correspond aux Néandertaliens de l’Altaï vivant dans de petites communautés. De plus, sur la base du temps de coalescence moyen plus court pour les chromosomes Y que pour l’ADNmt et des variantes d’ADNmt partagées entre les individus de Chagyrskaya et d’Okladnikov, nous suggérons que ces petites communautés néandertaliennes étaient principalement liées par la migration féminine.
Nos résultats soulèvent des questions quant à savoir si les caractéristiques des communautés de l’Altaï sont liées à leur situation géographique isolée à l’extrémité orientale de l’aire de répartition connue des Néandertaliens (en particulier parce que la taille de la population de la grotte de Vindija était probablement plus grande).5), ou s’ils sont caractéristiques des communautés néandertaliennes en général.
Les études futures devraient donc, lorsque cela est possible, viser à échantillonner plusieurs individus de communautés néandertaliennes supplémentaires dans d’autres parties de l’Eurasie pour éclairer davantage l’organisation sociale de nos plus proches parents évolutionnaires.
Méthode
Aucune méthode statistique n’a été utilisée pour prédéterminer la taille de l’échantillon. Les expériences n’ont pas été randomisées et les chercheurs n’ont pas été mis en aveugle lors de l’attribution pendant les expériences et l’évaluation des résultats. Une description détaillée de toutes les analyses effectuées dans le cadre de cette étude est incluse dans lesrenseignements supplémentaires. L’autorisation de travailler sur les spécimens archéologiques a été accordée sur la base d’un accord écrit de coopération scientifique signé en 2018 par l’Institut fédéral d’archéologie et d’ethnographie, la branche sibérienne de l’Académie des sciences de Russie et l’Institut Max Planck d’anthropologie évolutive.
Résumé des rapports
De plus amples renseignements sur la conception de la recherche sont disponibles dans leRésumé des rapports de recherchesur la nature lié à cet article.
Disponibilité des données
Les données brutes de chaque bibliothèque sont disponibles dans les Archives européennes des nucléotides sous le numérod’acquisition PRJEB55327. Les fichiers BAM cartographiés pour tous les spécimens et individus, les fichiers VCF, les séquences d’ADNmt FASTA de consensus et un alignement multiple de tous les ADNmt peuvent être téléchargés à partir dehttp://ftp.eva.mpg.de/neandertal/ChagyrskayaOkladnikov/.
Références
- Green, R. E. et coll. Une ébauche de séquence du génome de Néandertal. Science328, 710-722 (2010).Annonces CAS PubMed PubMed Central Google Scholar
- Prüfer, K. et al. La séquence complète du génome d’un Néandertalien des montagnes de l’Altaï. Nature505, 43-49 (2014).Annonces PubMed Google Scholar
- Prüfer, K. et al. Un génome néandertalien à haute couverture de la grotte de Vindija en Croatie. Science358, 655-658 (2017).Annonces PubMed PubMed Central Google Scholar
- Hajdinjak, M. et al. Reconstruire l’histoire génétique des Néandertaliens tardifs. Nature555, 652-656 (2018).Annonces CAS PubMed PubMed Central Google Scholar
- Mafessoni, F. et al. Un génome néandertalien à haute couverture de la grotte de Chagyrskaya. Proc. Natl Acad. Sci. USA 117, 15132–15136 (2020).Annonces CAS PubMed PubMed Central Google Scholar
- Peyrégne, S. et al. L’ADN nucléaire de deux premiers Néandertaliens révèle 80 000 ans de continuité génétique en Europe. Sci. Adv. 5, EAAW5873 (2019).Annonces PubMed PubMed Central Google Scholar
- Bokelmann, L. et al. Une analyse génétique des Néandertaliens de Gibraltar. Proc. Natl Acad. Sci. USA 116, 15610–15615 (2019).Annonces CAS PubMed PubMed Central Google Scholar
- Meyer, M. et al. Séquences d’ADN nucléaire des hominidés Sima de los Huesos du Pléistocène moyen. Nature531, 504-507 (2016).Annonces CAS PubMed Google Scholar
- Derevianko, A. P. et al.Multidisciplinary Studies of Chagyrskaya Cave–A Middle Paleolithic Site in Altai (Institut d’archéologie et d’ethnographie de la branche sibérienne de l’Académie des sciences de Russie, 2018).
- Kolobova, K. A. et coll. Preuves archéologiques de deux dispersions distinctes de Néandertaliens dans le sud de la Sibérie. Proc. Natl Acad. Sci. USA117, 2879–2885 (2020).Annonces CAS PubMed PubMed Central Google Scholar
- Derevianko, A. P. & Markin S. V.Mustye Gornogo Altaya [Le moustérien de l’Altaï montagneux] (Nauka, 1992).
- Arsuaga, J. L. et al. Racines néandertaliennes: preuves crâniennes et chronologiques de Sima de los Huesos. Science344, 1358-1363 (2014).Annonces CAS PubMed Google Scholar
- Higham, T. et coll. Le moment et la structure spatio-temporelle de la disparition de Néandertal. Nature512, 306-309 (2014).Annonces CAS PubMed Google Scholar
- Meyer, M. et al. Une séquence génomique à haute couverture d’un individu sésovien archaïque. Science338, 222-226 (2012).Annonces CAS PubMed PubMed Central Google Scholar
- Kappeler, P. M. & van Schaik, C. P. Evolution of primate social systems. J. Primatol. 23, 707 à 740 (2002).Google Scholar
- Duveau, J., Berillon, G., Verna, C., Laisné, G. & Cliquet, D. La composition d’un groupe social néandertalien révélée par les empreintes d’hominidés au Rozel (Normandie, France). Proc. Natl Acad. Sci. USA 116, 19409–19414 (2019).Annonces CAS PubMed PubMed Central Google Scholar
- Mayoral, E. et al. Traquage des Néandertaliens du Pléistocène supérieur sur la côte ibérique. Sci. Rep.11, 4103 (2021).Annonces CAS PubMed PubMed Central Google Scholar
- Vallverdú, J. et al. Zone d’activité dormante dans la structure du site de groupes humains archaïques. Curr. Anthropol. 51, 137 à 145 (2010).Google Scholar
- Lalueza-Fox, C. et coll. Preuves génétiques du comportement d’accouplement patrilocal chez les groupes néandertaliens. Proc. Natl Acad. Sci. USA108, 250–253 (2011).Annonces CAS PubMed Google Scholar
- Vigilant, L. & Langergraber, K. E. Preuves non concluantes de la patrilocalité chez les Néandertaliens. Proc. Natl Acad. Sci. USA108, E87 (2011).Annonces CAS PubMed PubMed Central Google Scholar
- Kolobova, K. et coll. Exploitation de l’environnement naturel par les Néandertaliens de la grotte de Chagyrskaya (Altaï). Quartär66, 7-31 (2019).
- Derevianko, A. P., Markin, S. V. & Shunkov, M. V. Le faciès Sibiryachikha du Paléolithique moyen de l’Altaï. Archéol. Ethnol. Anthropol. Euras. 41, 89-103 (2013).Google Scholar
- Kharevich, A. V. et coll. Nouveaux sites archéologiques dans le nord-ouest de l’Altaï (districts de Krasnoschekovsky et Soloneshensky du kraï de l’Altaï). Problèmes d’archéologie, d’ethnographie, d’anthropologie de la Sibérie et des territoires voisins26, 263-270 (2020).
- Higham, T. F. G. Elimination contaminants: a restatement of the value of isolating single compounds for AMS dating. Antiquité93, 1072-1075 (2019).Google Scholar
- Slon, V. et coll. Le génome de la progéniture d’une mère néandertalienne et d’un père dénisovie. Nature561, 113-116 (2018).Annonces CAS PubMed PubMed Central Google Scholar
- Petr, M. et al. L’histoire évolutive des chromosomes Y de Néandertal et de Denisova. Science369, 1653-1656 (2020).Annonces CAS PubMed Google Scholar
- Monroy Kuhn, J. M., Jakobsson, M. & Günther, T. Estimating genetic kin relationships in prehistoric populations. PLoS ONE13, e0195491 (2018).PubMed PubMed Central Google Scholar
- Ivanov, P. L. et coll. L’hétéroplasmie de séquence d’ADN mitochondrial chez le grand-duc de Russie Georgij Romanov établit l’authenticité des restes du tsar Nicolas II. Nat. Genet. 12, 417-420 (1996).CAS PubMed Google Scholar
- Stewart, J. B. et Chinnery, P. F. La dynamique de l’hétéroplasmie de l’ADN mitochondrial: implications pour la santé humaine et la maladie. Révérend Nat. Genet. 16, 530 à 542 (2015).CAS PubMed Google Scholar
- Vernot, B. et al. Unearthing Neandertal population history using nuclear and mitochondrial DNA from cave sediments. Science372, eabf1667 (2021).CAS PubMed Google Scholar
- Stewart, N. A., Gerlach, R. F., Gowland, R. L., Gron, K. J. & Montgomery, J. Sex determination of human remains from peptides in tooth enamel. Proc. Natl Acad. Sci. USA 114, 13649–13654 (2017).Annonces CAS PubMed PubMed Central Google Scholar
- Douka, K. et coll. Estimations de l’âge pour les fossiles d’hominidés et le début du Paléolithique supérieur à la grotte de Denisova. Nature565, 640-644 (2019).Annonces CAS PubMed Google Scholar
- Peter, B. M. 100 000 ans de flux génétique entre Néandertaliens et Denisovans dans les montagnes de l’Altaï. Prépublication àbioRxivhttps://doi.org/10.1101/2020.03.13.990523(2020).
- Zavala, E. I. et al. L’ADN des sédiments du Pléistocène révèle des rotations d’hominidés et de faune dans la grotte de Denisova. Nature595, 399-403 (2021).Annonces CAS PubMed PubMed Central Google Scholar
- Jacobs, Z. et coll. Moment de l’occupation archaïque des hominidés de la grotte de Denisova dans le sud de la Sibérie. Nature565, 594-599 (2019).Annonces CAS PubMed Google Scholar
- Ceballos, F. C., Joshi, P. K., Clark, D. W., Ramsay, M. & Wilson, J. F. Runs of homozygosity: windows into population history and trait architecture. Révérend Nat. Genet. 19, 220 à 234 (2018).CAS PubMed Google Scholar
- Xue, Y. et al. Les génomes des gorilles de montagne révèlent l’impact du déclin à long terme de la population et de la consanguinité. Science348, 242-245 (2015).Annonces CAS PubMed PubMed Central Google Scholar
- Robbins, M. M. & Robbins, A. M. Variation dans l’organisation sociale des gorilles: histoire de vie et perspectives socioécologiques. Evol. Anthropol. 27, 218 à 233 (2018).PubMed Google Scholar
- Vigilant, L. et al. Compétition reproductive et évitement de la consanguinité chez une espèce de primate avec dispersion habituelle des femelles. Comportement de l’Ecol. Sociobiol. 69, 1163-1172 (2015).Google Scholar
- Langergraber, K. E. et coll. Quel âge ont les communautés de chimpanzés ? Temps jusqu’à l’ancêtre commun le plus récent du chromosome Y dans les sociétés hautement patrilocales. J. Hum. Evol. 69, 1-7 (2014).PubMed Google Scholar
- Skoglund, P. et al. Séparer l’ADN ancien endogène de la contamination moderne chez un Néandertalien sibérien. Natl Acad. Sci. USA111, 2229–2234 (2014).Annonces CAS PubMed PubMed Central Google Scholar
- Andrews, R. et coll. Réanalyse et révision de la séquence de référence de Cambridge pour l’ADN mitochondrial humain. Nat. Genet. 23, 147 (1999).CAS PubMed Google Scholar
- Briggs, A. W. et coll. Récupération et analyse ciblées de cinq génomes d’ADNmt de Néandertal. Science 325, 318-321 (2009).Annonces CAS PubMed Google Scholar
- Brown, S. et coll. Identification d’un nouvel os d’hominidé de la grotte de Denisova, en Sibérie, à l’aide de l’empreinte digitale du collagène et de l’analyse de l’ADN mitochondrial. Sci. Rep.6, 23559 (2016).Annonces CAS PubMed PubMed Central Google Scholar
- Douka, K. et coll. Estimations de l’âge pour les fossiles d’hominidés et le début du Paléolithique supérieur à la grotte de Denisova. Nature565, 640-644 (2019).Annonces CAS PubMed Google Scholar
- Sawyer, S. et coll. Séquences d’ADN nucléaire et mitochondrial de deux individus de Denisova. Proc. Natl Acad. Sci. USA. 112, 15696-15700 (2015).Annonces CAS PubMed PubMed Central Google Scholar
- Krause, J. et coll. Le génome complet de l’ADN mitochondrial d’un hominidé inconnu du sud de la Sibérie. Nature464, 894-897 (2010).Annonces CAS PubMed Google Scholar
- Slon, V. et coll. Un quatrième individu de Denisova. Sci. Adv. 3, e1700186 (2017).Annonces Google Scholar
- Meyer, M. et al. Séquence du génome mitochondrial d’un hominidé de Sima de los Huesos. Nature505, 403-406 (2014).Annonces CAS PubMed Google Scholar
- Skaletsky, H. et al. La région spécifique au mâle du chromosome Y humain est une mosaïque de classes de séquences discrètes. Nature 423, 825-837 (2003).Annonces CAS PubMed Google Scholar
- Mallick, S. et coll. Le Simons Genome Diversity Project : 300 génomes provenant de 142 populations diverses. Nature538, 201-206 (2016).Annonces CAS PubMed PubMed Central Google Scholar
- Karmin, M. et al. Un goulot d’étranglement récent de la diversité du chromosome Y coïncide avec un changement mondial de culture. Rés. du génome 25, 459 à 466 (2015).CAS PubMed PubMed Central Google Scholar
- Mendez, F. L. et coll. Une lignée paternelle afro-américaine ajoute une racine extrêmement ancienne à l’arbre phylogénétique du chromosome Y humain. Am. J. Hum. Genet. 92, 454 à 459 (2013); erratum92, 637 (2013).CAS PubMed PubMed Central Google Scholar
- Viola, B.Nouveaux restes d’hominidés d’Asie centrale et de Sibérie: les Néandertaliens les plus orientaux? Thèse de doctorat, Université de Vienne (2009).
- Krause, J. et coll. Néandertaliens en Asie centrale et en Sibérie. Nature449, 902-904 (2007).Annonces CAS PubMed Google Scholar
- Mednikova, M. B.Postkranialnaya Morfologiya i Taksonomiya Predstavitelei Roda Homo iz Peschery Okladnikova na Altae(IAE SO RAN, Izd, 2011).
Remerciements
Nous remercions D. Lucas et C. Logan pour leurs commentaires sur une version antérieure du manuscrit; H. Temming pour la réalisation de tomodensitométries; S. Sawyer et J. Krause, qui ont foré les os de Chagyrskaya 2 et Chagyrskaya 6; R. Schultz pour avoir aidé à récupérer les photographies numériques des échantillons et à télécharger les fichiers de données primaires. V.S. a été financé par la bourse Alon, M.H. a été financé par Marie Skłodowska Curie Action (MSCA-IF-EF-ST LIF, « ORIGIN » no. 844014), S.T. a été financé par le Conseil européen de la recherche Horizon 2020 Programme de recherche et d’innovation subvention « RESOLUTION » (n ° 803147), K.D. a été financé par le Conseil européen de la recherche Horizon 2020 Programme de recherche et d’innovation subvention « FINDER » (n ° 715069), R.G.R. a été financé par la bourse FL130100116 du Conseil australien de la recherche, T.H. a été financé par le Conseil européen de la recherche Septième programme-cadre (FP7/2007-2013) subvention 324139 « PalaeoChron », K.A.K. a été financé par la Fondation russe pour la science, le projet N 21-18-00376, M.T.K. a été financé par le Centre national des sciences, Pologne, subvention 2018/29/B/ST10/00906, B.V. a été financé par le Conseil de recherches en sciences humaines, Canada, subvention Savoir 435-2018-0943. Ce projet a été financé par le Conseil européen de la recherche (convention de subvention n° 694707 à S. Pääbo).
Financement
Financement en libre accès fourni par la Société Max Planck.
Informations sur l’auteur
Auteurs et affiliations
- Département de génétique évolutive, Institut Max Planck d’anthropologie évolutionniste, Leipzig, AllemagneLaurits Skov, Stéphane Peyrégne, Divyaratan Popli, Leonardo N. M. Iasi, Viviane Slon, Elena I. Zavala, Mateja Hajdinjak, Arev P. Sümer, Steffi Grote, Alba Bossoms Mesa, David López Herráez, Birgit Nickel, Sarah Nagel, Julia Richter, Elena Essel, Marie Gansauge, Anna Schmidt, Petra Korlević, Janet Kelso, Matthias Meyer, Svante Pääbo & Benjamin M. Peter
- Centre européen de recherche et d’enseignement en géosciences de l’environnement (CEREGE), Aix-Marseille Université, CNRS, IRD, INRAE, Collège de France, Aix-en-Provence, FranceThibaut Devièse
- Département d’anatomie et d’anthropologie Sackler, Faculté de médecine, Université de Tel Aviv, Tel Aviv, IsraëlViviane Slon
- Le Centre Dan David pour l’évolution humaine et la recherche en biohistoire, Université de Tel Aviv, Tel Aviv, IsraëlViviane Slon
- Département de génétique moléculaire humaine et de biochimie, Faculté de médecine Sackler, Université de Tel Aviv, Tel Aviv, IsraëlViviane Slon
- The Francis Crick Institute, Londres, Royaume-UniMateja Hajdinjak
- Wellcome Sanger Institute, Hinxton, Royaume-UniPetra Korlević
- Oxford Radiocarbon Accelerator Unit, Laboratoire de recherche pour l’archéologie et l’histoire de l’art, Université d’Oxford, Oxford, Royaume-UniDaniel Comeskey
- Institut d’archéologie et d’ethnographie, Académie des sciences de Russie, Novossibirsk, RussieAnatoly P. Derevianko, Aliona Kharevich, Sergey V. Markin, Andrey I. Krivoshapkin & Kseniya A. Kolobova
- Département de chimie G. Ciamician, Alma Mater Studiorum, Université de Bologne, Bologne, ItalieSahra Talamo
- Département de l’évolution humaine, Institut Max Planck d’anthropologie évolutionniste, Leipzig, AllemagneSahra Talamo
- Département d’anthropologie évolutionniste, Faculté des sciences de la vie, Université de Vienne, Vienne, AutricheKaterina Douka et Thomas Higham
- Département d’archéologie, Institut Max Planck pour la science de l’histoire humaine, Iéna, AllemagneKaterina Douka
- Évolution humaine et sciences archéologiques Forschungsverbund, Université de Vienne, Vienne, AutricheKaterina Douka et Thomas Higham
- Institut des sciences géologiques, Académie polonaise des sciences, Varsovie, PologneMaciej T. Krajcarz
- Centre for Archaeological Science, School of Earth, Atmospheric and Life Sciences, Université de Wollongong, Wollongong, Nouvelle-Galles du Sud, AustralieRichard G. Roberts
- Australian Research Council (ARC) Centre of Excellence for Australian Biodiversity and Heritage, Université de Wollongong, Wollongong, Nouvelle-Galles du Sud, AustralieRichard G. Roberts
- Département d’anthropologie, Université de Toronto, Toronto, Ontario, CanadaBence Alto
Contributions
L.S., S. Pääbo et B.M.P. ont conçu l’étude. A.P.D., A.K., S.V.M., A.I.K. et K.A.K. ont recueilli des échantillons. T.D., V.S., M.H., B.N., S.N., J.R., E.E., M.G., A.S., P.K., D.C., S.T., T.H. et B.V. ont effectué des expériences et/ou des analyses en laboratoire. L.S., S. Peyrégne, D.P., L.N.M.I., T.D., V.S., E.I.Z., M.H., A.P.S., S.G., A.B.M., D.H.L., D.C., A.P.D., A.K., S.V.M., S.T., K.D., M.T.K., R.G.R., T.H., B.V., A.I.K., K.A.K. et B.M.P. ont effectué des analyses. L.S., S. Peyrégne, D.P., L.N.M.I., T.D., V.S., E.I.Z., M.H., A.P.S., A.B.M., D.H.L., S.T., K.D., M.T.K., R.G.R., T.H., B.V., A.I.K., K.A.K., J.K., M.M., S. Pääbo et B.M.P. ont écrit le manuscrit avec la contribution de tous les auteurs. A.P.D., A.K., S.V.M., K.D., M.T.K., R.G.R., T.H., B.V., A.I.K. et K.A.K. ont fourni un contexte et une interprétation archéologiques, stratigraphiques et géochronologiques.
Auteurs correspondants
Déclarations éthiques
Conflits d’intérêts
Les auteurs ne déclarent aucun intérêt concurrent.
Examen par les pairs
Renseignements sur l’examen par les pairs
Natureremercie Krishna Veeramah, Katharine MacDonald et les autres examinateurs anonymes pour leur contribution à l’examen par les pairs de ce travail. Les rapports des pairs examinateurssont disponibles.
Informations complémentaires
Note de l’éditeur Springer Nature reste neutre en ce qui concerne les revendications juridictionnelles dans les cartes publiées et les affiliations institutionnelles.
Figures et tableaux de données étendus
Données étendues Fig. 1 Grottes de Chagyrskaya et d’Okladnikov.
A, Carte de localisation des grottes de Chagyrskaya et d’Okladnikov dans la région de l’Altaï au sud de la Sibérie. Vue sur leB, entrée nord de la grotte Chagyrskaya etC, entrée sud de la grotte Okladnikov.
Données étendues Fig. 2 Plan carte de la grotte de Chagyrskaya et emplacements des restes de Néandertal.
A, Distribution spatiale des restes néandertaliens. La zone excavée est représentée en gris et la ligne bleue (transect A-B) marque la position du profil stratigraphique indiqué enB. Les carrés colorés et les ellipses désignent des restes de Néandertal situés avec des coordonnées exactes ou dans les zones circonscrites, respectivement, et sont annotés avec le(s) numéro(s) fossile(s) correspondant(s). B, profil stratigraphique le long du transect A–B dansA. Les emplacements des restes de Néandertal sont projetés orthogonalement sur ce profil, de sorte que chaque fossile n’est pas nécessairement représenté dans l’unité stratigraphique à partir de laquelle il a été récupéré.
Données étendues Fig. 3 Les différences normalisées par paires entre Chagyrskaya et Okladnikov demeurent.
A, Les points montrent les différences moyennes par paires (axe des y) entre deux restes (normalisées par la différence médiane entre toutes les paires de restes). Les restes qui ont été identifiés comme des parents identiques, au premier degré et au deuxième degré sont nommés (l’axe des x montre le premier fossile et le nombre indique le second reste). Les barres d’erreur sont des intervalles de confiance à 95 % pour 100 estimations bootstrap des différences moyennes par paires. Les lignes horizontales indiquent la différence normalisée attendue pour les personnes identiques, les relations au premier degré, les relations au deuxième degré et les personnes non apparentées.27. B, Chaque cercle/carré représente un individu (bleu pour Chagyrskaya, orange pour Okladnikov) et les petits cercles blancs indiquent quels restes proviennent de cet individu. Le cercle noir pourChagyrskaya 8indique que la séquence génomique de cet os a déjà été publiée. Les carrés indiquent que l’individu est un homme et les cercles indiquent que l’individu est une femme. Les individus qui sont des parents au premier degré, des parents au deuxième degré ou qui partagent des hétéroplasmies sont marqués.
Données étendues Fig. 4 Partage de variantes entre génomes archaïques.
Le centre de la barre d’erreur montre la statistique D de la formeD((Denisova 5/Vindija33.19),Chagyrskaya 8; Test, Chimpanzé) et les barres d’erreur sont les intervalles de confiance à 95 % correspondants calculés pour 643 472 SNP à l’aide d’un jackknife de bloc pondéré et d’une taille de bloc de 5 Mo. Points avec | Score Z| > 2 sont annotées d’un astérisque. La ligne verticale pointillée est à D = 0. Notez que Chagyrskaya F est le même individu queChagyrskaya 8etVindijaG1est le même individu queVindija 33.19.
Données étendues Fig. 5 Délétion du gèneAMELYsur le chromosome Y.
Délétion de 1,8 Mo de séquence sur le chromosome Y deMezmaiskaya 2 (panneau inférieur, gris clair) par rapport àChagyrskaya D (panneau supérieur, pas de délétion). L’axe horizontal montre la position génomique sur le chromosome Y et l’axe vertical montre la couverture en bins de 10 kb, normalisée par la couverture moyenne à l’échelle du chromosome. Les couleurs des bacs indiquent les classes de régions sur le chromosome Y de référence humain, les régions plus foncées indiquant la couverture par le réseau de capture du chromosome Y. Les barres noires indiquent des gènes codants connus.
Données étendues Fig. 6 Ratios de l’ADN mitochondrial à la diversité du chromosome Y.
Les cercles noirs indiquent les estimations moyennes pour chaque population et les barres d’erreur sont les intervalles de confiance correspondants à 95 % en utilisant 100 itérations bootstrap. Les valeurs négatives indiquent une diversité du chromosome Y inférieure à celle de l’ADN mitochondrial (mt).Tableau de données étendu 1 Restes de Néandertal provenant des grottes de Chagyrskaya et d’Okladnikov inclus dans cette étude pour analyse de l’ADN ou14Rencontres CTable pleine grandeur
Renseignements supplémentaires
Renseignements supplémentaires
Une description détaillée de toutes les analyses effectuées dans le cadre de cette étude est fournie dans les sections 1 à 10 des renseignements supplémentaires, les figures supplémentaires 1 à 42, les tableaux supplémentaires 1 à 44 et les références supplémentaires.
Résumé des rapports
Données supplémentaires 1
Toutes les informations sur le séquençage des bibliothèques, y compris le traitement et la complexité des bibliothèques et les estimations de contamination.
Dossier d’examen par les pairs
Droits et autorisations
Libre accès Cet article est sous licence Creative Commons Attribution 4.0 International, qui autorise l’utilisation, le partage, l’adaptation, la distribution et la reproduction sur tout support ou format, à condition que vous donniez le crédit approprié au(x) auteur(s) original(s) et à la source, fournissez un lien vers la licence Creative Commons et indiquez si des modifications ont été apportées. Les images ou autres éléments de tiers contenus dans cet article sont inclus dans la licence Creative Commons de l’article, sauf indication contraire dans une ligne de crédit du matériel. Si le matériel n’est pas inclus dans la licence Creative Commons de l’article et que votre utilisation prévue n’est pas autorisée par la réglementation légale ou dépasse l’utilisation autorisée, vous devrez obtenir l’autorisation directement du détenteur des droits d’auteur. Pour afficher une copie de cette licence, visitezhttp://creativecommons.org/licenses/by/4.0/.
Réimpressions et autorisations
À propos de cet article
Citer cet article
Skov, L., Peyrégne, S., Popli, D.et al. Aperçu génétique de l’organisation sociale des Néandertaliens. Nature610, 519-525 (2022). https://doi.org/10.1038/s41586-022-05283-y
- Reçu21 février 2022
- Accepté26 août 2022
- Publié19 octobre 2022
- Date d’émission20 octobre 2022
- Doihttps://doi.org/10.1038/s41586-022-05283-y
Partager cet article
Toute personne avec qui vous partagez le lien suivant pourra lire ce contenu :Obtenir un lien partageable
Fourni par l’initiative de partage de contenu Springer Nature SharedIt
Subjects
Commentaires
En soumettant un commentaire, vous acceptez de respecter nosConditionset lesRègles de la communauté. Si vous trouvez quelque chose d’abusif ou qui n’est pas conforme à nos conditions ou directives, veuillez le signaler comme inapproprié.
Views: 4






Luc Laforets
L’image présentée est empreinte d’un certain « racisme ».
Voici à quoi il ressemblait plutôt :
et plus loin :
Des tests ADN ont démontré que Néandertal possédait la peau claire, et au moins certaines sous-espèces avait les cheveux rougeâtre également.
Source : https://www.eupedia.com/europe/neanderthal_faits_et_mythes.shtml#traits
Alain Girard
Yeux bleus et peau pâle, et 300 000 années d’adaptations et rien qui nous précise la datation de cette illustration, début, milieu, apogée.
Pour ma part, je ne vois pas une volonté de discriminer, de démontrer une quelconque supériorité de « race ». C’est mon côté gro magnon.